Uvod
Morbus Wilson se naziva i Kinnier Wilsonova bolest, Westphal-ova pseudoskleroza, Westphal- Strümpell-ova bolest, Westphal-Strümpell-ova pseudoskleroza, Westphal-Strümpell-ov sindrom, Wilson-Konoval-ova hepato-cerebralna distrofija.
Wilsonova bolest predstavlja progresivno autozomno recesivno oboljenje, koje karakterišu poremećaj transporta i prekomerna akumulacija bakra u jetri, CNS-u, očima i drugim organima (1.). Bolest je urođena, nasleđuje se autozomno recesivno, klinički se manifestuje u detinjstvu ili adolescenciji najčešće između 6. i 12. godine. Smatra se da se ne ispoljava pre 5. i posle 50. godine života. Prevalenca oboljenja u populaciji je od 1:200000 (2.) do 1:300000.
Istorijat
Prvi je obolenje opisao Friedrich Theodor von Frerichs 1854. godine (3.) zatim Karl Friedrich Otto Westphal 1883. (4.) i Adolf von Strümpell 1898. godine (5.). Ime von Frerichs-a se kasnije ne spominje iako je prvi ovo obolenje nazvao porodičnom hepatolentikularnom degeneracijom. Westphal i Strümpell opisali su klinčki sindrom vrlo sličan multiploj sklerozi, koji je po njima dobio ime Vestfal-Štimpelov-a pseudoskleroza. Samuel Alexander Kinnier Wilson 1912. (6.) opisuje neurološki poremećaj koji prati izraziti tremor i podseća na parkinsonizam. Uočio je da je ovo porodično obolenje, koje je udruženo sa cirozom jetre. Od tada usvojen je naziv Wilsonova bolest, sa kliničkim oblicima u kojima su zahvaćene bazalne ganglije nervnog sistema i jetra, odakle i potče naziv hepatolentikularna degeneracija. U novije vreme spominje se i N. V. Konovalov koji oboljenje naziva hepato-cerebralnom distrofijom (7.).
Metabolizam bakra
Bakar je oligoelement, koji se u organizmu nalazi u mozgu, jetri, manje u bubrezima, srcu, kosi. Ukupna količina oko 80 mg. Najvećim delom se apsorbuje u duodenumu, i to L-amino kiselinama i proteinom, za koji se vezuje na luminarnoj strani mukoze. U mukozi se vezuje za Metalotioneinu sličan protein, koji je bogat sulfhidrilnim grupama, i formira merkaptidne veze. Ovaj protein je ujedno i depo Cu u mukozi, a samim tim je i bitan u homeostatskoj regulaciji nivoa Cu u organizmu. Cu se oslobađa na seroznoj strani mukoze i ulazi u cirkulaciju, gde se vezuje za albumine i transportuje do jetre. U jetri se deponuje u vidu Kuproproteina. Iz jetre odlazi u cirkulaciju, gde se 90-95% transportuje vezan za Ceruloplazmin a preostalih 5-10% labavo vezani za albumine ili u eritrocitima u vidu Eritrokuprona. Bakar je u organizmu neophodni deo mnogih metaloenzima, Äiji poremećaj utiče na metabolizam:
• Amin-oxidaza – defekt skeletnih, mišicnih, vaskularnih tkiva;
• Citohrom-oxidaza – neurološki poremećaji;
• Kuproenzimi – poremećaj metabolizma kateholamina;
• Ceruloplazmin – ferooxidaza neophodna za prevodenje gvožđa iz fero u feri oblik pre vezivanja za transferin.
Do sada su poznate 3 bolesti – posledice poremećaja metabolizma bakra:
• M. Wilson,
• Mekes-ova bolest i
• Occipital horn syndrom.
Klinička slika
Jetra:
Kod svih pacijenata postoji prekomerna akumulacija Cu u jetri. Može se prezentovati u vidu asimptomatske hepatomegalije i/ili splenomegalije ili kao klinički manifestni: akutni hepatitis, hronični aktivni hepatitis, ciroza jetre, fulminantni hepatitis.
Nervni sistem:
Bolest se karakteriše taloženjem Cu u bazalnim ganglijama i talamusu. U zavisnosti od uzrasta pacijenta kada neurološki simptomi postaju manifestni, postoje dva klinička oblika: juvenilni oblik,koji je prvi opisao Wilson sa kliničkom slikom sličnom parkinsonizmu. Drugi, pseudosklerozni oblik, opisali su Vestfal i Štimpel (9.).
Oči:
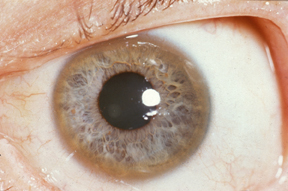 Taloženje bakra u vidu prstenova u Descementovoj membrani cornee. Vidi se u vidu zeleno-sivog do zeleno-žutog prstena, Kajzer-Flajšer-ov prsten. Ime je dobio po B. Kayser-u i R. Fleischer-u. Ovaj klinčki znak javlja se kod 75% dece koja imaju oštecenje jetre; kod 100% dece koja imaju neurološke ispade (10).
Taloženje bakra u vidu prstenova u Descementovoj membrani cornee. Vidi se u vidu zeleno-sivog do zeleno-žutog prstena, Kajzer-Flajšer-ov prsten. Ime je dobio po B. Kayser-u i R. Fleischer-u. Ovaj klinčki znak javlja se kod 75% dece koja imaju oštecenje jetre; kod 100% dece koja imaju neurološke ispade (10).
Bubrezi:
Dovodi do glomerularne i tubularne disfunkcije. Manifestuje se u vidu renalne tubularne acidoze, aminoacidurije, glikozurije, fosfaturije. Oštecenje bubrega nikada ne dodvodi do definitivne bubrežne insuficijencije (11.).. česte su urolitijaze.
Ostalo:
Bolesnici sa Wilson-ovom bolešcu u fulminantnom obliku bolesti najcešce imaju hemolitičku, Coombs negativnu, anemiju. (12.). Prisustvo hemolitičke anemije, uz postojanje hepatitisa, može, uz ostale tegobe, ukazati na postojanje Wilson-ove bolesti. (13.).
Pojava kardiomiopatija i/ili aritmija, holelitijaza, artralgija se, po nekima, javlja i kod 50% pacijenata (14.)
Etiopatogeneza
U osnovi oboljenja je autozomno recesivna malformacija u sintezi a2 globulina, proteina Ceruloplazmina. Zbog nedostatka transportnog proteina bakra, ceruloplazmina, povećava se nivo slobodnog bakra u cirkulaciji i vezanog za albumine plazme. Vezivanje bakra za albumine je slaba veza, što omogucuje njegovo taloženje u jetri, centralnom nervnom sistemu,očima i drugim organima.
Novijim istraživanjima pokazano je da je u osnovi autozomno recesivno prenosiva posebnost gena za ATP-azu, tip-B. Gen se nalazi na dugom kraku 13. hromozoma gde oboljevanjem mutira H1069Q, 2299insC, 3400delC
Mutacije gena izaziva
-prepunjenje jetre, toksična akumulacija Cu
-defekt za jetru specifičnog transporta Cu
-defekt ekskrecije Cu u žuč, akumulacija Cu u bazalne ganglijee i talamus mozga, proksimalni tubuli bubrega, cornea.
Dijagnoza
Na dijagnozu ukazuju: postojanje hepatitisa ili ciroze jetre nejasne etiologije kod mladih.
• Serum: blago povećanje transaminaza; povećanje ukupnog bilirubina; parametri smanjenja sintetske funkcije jetre: pad albumina, faktora koagulacije, produženo PT; smanjena koncentracija bakra u serumu (inicijalno postoji porast Cu u serumu); smanjenje ceruloplazmina u serumu (normalno 0,2 g/l);
• pojava Kajzer-Flajšer-ovih prstenova;
• pad hemoglobina sa hemolizom, ali Coombs negativni;
• povećanje bakra u 24h-om urinu (normalno 4 µg/24h), preko 100 µg/24h a kod težih sluÄajeva 1000 µg/24h. OdreÄ‘ivanje Cu u 24h-om urinu ima visoku senzitivnost u dijagnostici pacijenata kod kojih zbog poremećaja koagulacije nije moguća biopsija jetre (15.);
• biopsija jetre: povećanje koncentracije bakra u bioptatu jetre (normalno 250 µg/g suve težine; oštećenje jetre u svim stepenima, nalaz hroničnog aktivnog hepatitisa.
• CT/NMR glave: degenerativne promene CNS-a: hipodenzitet bazalnih ganglija i talamusa, proširenje komorskog sistema, atrofija mozga.
• Veoma je značajno na vreme dijagnostikovanje bolesti pre delovanja Cu na centralni nervni sistem kad su simptomi očigledni (usporenost pokreta, otežan govor,nesigurnost u hodu, otežan hod nemogućnost obavljanja preciznih radnji) često se dešava otpor sredine prema osobama sa ovakvim simptomima jer odavaju utisak osobe pod dejstvom alkohola ili narkotika. Na vreme dijagnostikovana bolest pruža veće šanse za smanjenje posledica bolesti i njihovo svođenje na neznatne.
Terapija
Osnovni lek je Penicilamin, a u upotrebi je od 1956. godine. Penicilamin gradi helatna jedinjenja sa Cu, na ovaj način mobiliše bakar iz tkiva i povećava njegovo izlučivanje urinom, od 1000-3000 µg/24h. Primena Penicilamina može dati i nusefekte: osip, ulcerozni stomatitis, leukopeniju, trombocitopeniju, aplastičnu anemiju, nefrotski sindrom, defekt vitamina B6, Cinka.
Ukoliko terapija Penicilaminom nije zadovoljavajuća a disfukncija jetre je progresivna, neophodna je transplantacija jetre.
Kod pacijenata kod kojih nije moguća primena Penicilamina, koristi se Triethilen Tetramin Dihydrochlorid (TETA).
Amonium Tetrathiomolybdat se pokazao kao odličan kod pacijenata sa neurološkim manifestacijama (16.). Pokazano je da primena Penicilamina može pogoršati neurološke manifestacije.
Cink acetat se pokazao kao efikasan lek u smanjenju preuzimanja Cu u digestivnom traktu. Cink acetat utiče na Metalotionein i blokira absorbiju Cu u enterocitima, a pored ovog utiče i na reapsorpciju Cu u pljuvačci, želudačnom soku i crevnom soku (17.,18.).
PROGNOZA:
Kod dobrog terapijskog odgovora dobra je i prognoza, goru prognozu imaju pacijenti sa neurološkim oblikom i varikozitetima jednjaka
